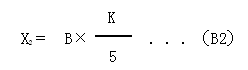|
范圍
本標準規定了一次性使用衛生用品的產品和生產環境衛生標準、消毒效果生物監測評價標準和相應檢驗方法,以及原材料與產品生產、消毒、貯存、運輸過程衛生要求和產品標識要求。
在本標準中,一次性使用衛生用品是指:
本標準適用于國內從事一次性使用衛生用品的生產與銷售的部門、單位或個人,也適用于經銷進口一次性使用衛生用品的部門、單位或個人。
引用標準
下列標準所包含的條文,通過在本標準中引用而構成為本標準的條文。本標準出版時,所示版本均為有效。所有標準都會被修訂,使用本標準的各方應探討使用下列標準新版本的可能性。
GB 15981-1995 消毒與滅菌效果的評價方法與標準
定義
本標準采用下列定義:
一次性使用衛生用品
使用一次后即丟棄的、與人體直接或間接接觸的、并為達到人體生理衛生或衛生保健(抗菌或抑菌)目的而使用的各種日常生活用品,產品性狀可以是固體也可以是液體。例如,一次性使用手套或指套(不包括醫用手套或指套)、紙巾、濕巾、衛生濕巾、電話膜、帽子、口罩、內褲、婦女經期衛生用品(包括衛生護墊)、尿布等排泄物衛生用品(不包括皺紋衛生紙等廁所用紙)、避孕套等,在本標準中統稱為“衛生用品”。
產品衛生指標
1 外觀必須整潔,符合該衛生用品固有性狀,不得有異常氣味與異物。
2 不得對皮膚與粘膜產生不良刺激與過敏反應及其他損害作用。
3 產品須符合表1中微生物學指標。
表1
4 衛生濕巾除必須達到表1中的微生物學標準外,對大腸桿菌和金黃色葡萄球菌的殺滅率須≥90%,如需標明對真菌的作用,還須對白色念珠菌的殺滅率≥90%,其殺菌作用在室溫下至少須保持1年。
5 抗菌(或抑菌)產品除必須達到表1中的同類同級產品微生物學標準外,對大腸桿菌和金黃色葡萄球菌的抑菌率須≥50%(溶出性)或>26%(非溶出性),如需標明對真菌的作用,還須白色念珠菌的抑菌率≥50%(溶出性)或>26%(非溶出性),其抑菌作用在室溫下至少須保持1年。
6 任何經環氧乙烷消毒的衛生用品出廠時,環氧乙烷殘留量必須≤250μg/g。
生產環境衛生指標
1 裝配與包裝車間空氣中細菌菌落總數應≤2 500 cfu/m3。
2 工作臺表面細菌菌落總數應≤20 cfu/cm2。
3 工人手表面細菌菌落總數應≤300 cfu/只手,并不得檢出致病菌。
消毒效果生物監測評價
1 環氧乙烷消毒:對枯草桿菌黑色變種芽胞(ATCC 9372)的殺滅指數應≥103。
2 電離輻射消毒:對短小桿菌芽胞E6d(ATCC 27142)的殺滅指數應≥103。
3 壓力蒸氣消毒:對嗜熱脂肪桿菌芽胞(ATCC 7953)的殺滅指數應≥103。
測試方法
1 產品測試方法
1.1 產品外觀:目測,應符合本標準3.1的規定。
1.2 產品毒理學測試方法:見附錄A。
1.3 產品微生物檢測方法:見附錄B。
1.4 產品殺菌性能、抑菌性能與穩定性測試方法:見附錄C。
1.5 產品環氧乙烷殘留量測試方法:見附錄D。
2 生產環境采樣與測試方法:見附錄E。
3 消毒效果生物監測評價方法:見附錄F。
原材料衛生要求
1 原材料應無毒、無害、無污染;原材料包裝應清潔,清楚標明內含物的名稱、生產單位、生產日期或生產批號;影響衛生質量的原材料應不裸露;有特殊要求的原材料應標明保存條件和保質期。
2 對影響產品衛生質量的原材料應有相應檢驗報告或證明材料,必要時需進行微生物監控和采取相應措施。
3 禁止使用廢棄的衛生用品作原材料或半成品。
生產環境與過程衛生要求
1 生產區周圍環境應整潔,無垃圾,無蚊、蠅等害蟲孳生地。
2 生產區應有足夠空間滿足生產需要,布局必須符合生產工藝要求,分隔合理,人、物分流,產品流程中無逆向與交叉。原料進入與成品出去應有防污染措施和嚴格的操作規程,減少生產環境微生物污染。
3 生產區內應配置有效的防塵、防蟲、防鼠設施,地面、墻面、工作臺面應平整、光滑、不起塵、便于除塵與清洗消毒,有充足的照明與空氣消毒或凈化措施,以保證生產環境滿足本標準第5章的規定。
4 配置必需的生產和質檢設備,有完整的生產和質檢記錄,切實保證產品衛生質量。
5 生產過程中使用易燃、易爆物品或產生有害物質的,必須具備相應安全防護措施,符合國家有關標準或規定。
6 原材料和成品應分開堆放,待檢、合格、不合格原材料和成品應嚴格分開堆放并設明顯標志。倉庫內應干燥、清潔、通風,設防蟲、防鼠設施與墊倉板,符合產品保存條件。
7進入生產區要換工作衣和工作鞋,戴工作帽,直接接觸裸裝產品的人員需戴口罩,清洗和消毒雙手或戴手套;生產區前應相應設有更衣室、洗手池、消毒池與緩沖區,
8 從事衛生用品生產的人員應保持個人衛生,不得留指甲,工作時不得戴手飾,長發應卷在工作帽內。痢疾、傷寒、病毒性肝炎、活動性肺結核、尖銳濕疣、淋病及化膿性或滲出性皮膚病患者或病原攜帶者不得參與直接與產品接觸的生產活動。
9 從事衛生用品生產的人員應在上崗前及定期(每年一次)進行健康檢查與衛生知識(包括生產衛生、個人衛生、有關標準與規范)培訓,合格者方可上崗。
消毒過程要求
1 消毒級產品終消毒必須采用環氧乙烷、電離輻射或壓力蒸氣等有效消毒方法,所用消毒設備必須符合有關衛生標準。
2 根據產品衛生標準、初始污染菌與消毒效果生物監測評價標準制定消毒程序、技術參數、工作制度,經驗證后嚴格按照既定的消毒工藝操作。該消毒程序、技術參數或影響消毒效果的原材料或生產工藝發生變化后應重新驗證確定消毒工藝。
3 每次消毒過程必須進行相應的工藝(物理)和化學指示劑監測,每月用相應的生物指示劑監測,只有當工藝監測、化學監測、生物監測達到規定要求時,被消毒物品才能出廠。
4 產品經消毒處理后,外觀與性能應與消毒處理前無明顯可見的差異。
包裝、運輸與貯存要求
1 執行衛生用品運輸或貯存的單位或個人,應嚴格按照生產者提供的運輸與貯存要求進行運輸或貯存。
2 直接與產品接觸的包裝材料必須無毒、無害、清潔,產品的所有包裝材料必須具有足夠的密封性和牢固性以達到保證產品在正常的運輸與貯存條件下不受污染的目的。
產品標識要求
1 產品標識應符合《中華人民共和國產品質量法》的規定,并在產品包裝上標明執行的衛生標準號以及生產日期和保質期(有效期)或生產批號和限定使用日期。
2 消毒級產品還應在銷售包裝上注明“消毒級”字樣以及消毒日期和有效期或消毒批號和限定使用日期,在運輸包裝上標明“消毒級”字樣以及消毒單位與地址、消毒方法、消毒日期和有效期或消毒批號和限定使用日期。
附 錄 A
(標準的附錄)
產品毒理學測試方法
A1 各類產品毒理學測試指標
當原材料、生產工藝等發生變化可能影響產品毒性時,應按表A1根據不同產品種類提供有效的(經政府認定的第三方)成品毒理學測試報告。
表A1
A2 試驗方法
皮膚刺激試驗、陰道粘膜刺激試驗和皮膚變態反應試驗方法按衛生部《消毒技術規范》(第三版)第一分冊《實驗技術規范》(1999)中的“消毒劑毒理學實驗技術”中相應的試驗方法進行。
固體產品的樣品制備方法按照A3進行。
注
1 用于皮膚刺激試驗中的空白對照應為:生理鹽水和斑貼紙。
2 在皮膚變態反應中,致敏處理和激發處理所用的劑量保持一致。
A3 樣品制備
A3.1 皮膚刺激試驗和皮膚變態反應試驗
以橫斷方式剪一塊斑貼大小的產品。對于干的產品,如尿布、婦女經期衛生用品,用生理鹽水潤濕后貼到皮膚上,再用斑貼紙覆蓋。濕的產品,如濕巾,則可以按要求裁剪合適的面積,直接貼到皮膚上,再用斑貼紙覆蓋。
A3.2 陰道粘膜刺激試驗
A3.2.1 干的產品(如婦女經期衛生用品)
以橫斷方式剪取足夠量的產品,按1g/10mL的比例加入滅菌生理鹽水,密封于萃取容器中攪拌后置于37℃±1℃下放置24h。冷卻到室溫,攪拌后析取樣液備檢。
A3.2.2 濕的產品(如衛生濕巾)
在進行陰道粘膜刺激試驗的當天,擠出濕巾里的添加液作為試樣。
A4 判定標準
以衛生部《消毒技術規范》(第三版)第一分冊《實驗技術規范》(1999)中“毒理學試驗結果的終判定”的相應部分作為試驗結果判定原則。
附錄B
(標準的附錄)
產品微生物檢測方法
B1 產品采集與樣品處理
于同一批號的三個運輸包裝中至少抽取12個小銷售包裝樣品,1/4樣品用于檢測,1/4樣品用于留樣,另1/2樣品(可就地封存)必要時用于復檢。抽樣的小銷售包裝不應有破裂,檢驗前不得啟開。
在100級凈化條件下用無菌方法打開用于檢測的至少3個包裝,從每個包裝中取樣,準確稱取10 g±1g樣品,剪碎后加入到200 mL滅菌生理鹽水中,充分混勻,得到一個生理鹽水樣液。液體產品用原液直接做樣液。
如被檢樣品含有大量吸水樹脂材料而導致不能吸出足夠樣液時,稀釋液量可按每次50mL遞增,直到能吸出足夠測試用樣液。在計算細菌菌落總數與真菌菌落總數時應調整稀釋度。
B2 細菌菌落總數與初始污染菌檢測方法
本方法適用于產品初始污染菌與細菌菌落總數(以下統稱為細菌菌落總數)檢測。
B2.1 操作步驟
待上述生理鹽水樣液自然沉降后取上清液作菌落計數。共接種5個平皿,每個平皿中加入1 mL樣液,然后用冷卻至45℃左右的熔化的營養瓊脂培養基15 ~20mL倒入每個平皿內混合均勻。待瓊脂凝固后翻轉平皿置35℃±2℃ 培養48h后,計算平板上的菌落數。
B2.2 結果報告
菌落呈片狀生長的平板不宜采用;計數符合要求的平板上的菌落,按式(B1)計算結果:
當菌落數在100以內,按實有數報告,大于100時采用二位有效數字。
如果樣品菌落總數超過本標準的規定,按B2.3進行復檢和結果報告。
B2.3 復檢方法
將留存的復檢樣品依前法復測2次,2次結果平均值都達到本標準的規定,則判定被檢樣品合格;其中有任何1次結果平均值超過本標準規定,則判定被檢樣品不合格。
B3 大腸菌群檢測方法
B3.1 操作步驟
取樣液5mL接種50mL乳糖膽鹽發酵管,置35℃±2℃ 培養24 h,如不產酸也不產氣,則報告為大腸菌群陰性。
如產酸產氣,則劃線接種伊紅美藍瓊脂平板,置35℃±2℃培養18~24 h,觀察平板上菌落形態。典型的大腸菌落為黑紫色或紅紫色,圓形,邊緣整齊,表面光滑濕潤,常具有金屬光澤,也有的呈紫黑色,不帶或略帶金屬光澤,或粉紅色,中心較深的菌落。
取疑似大腸菌落1~2個作革蘭氏染色鏡檢,同時接種乳糖發酵管,置35℃±2℃培養24 h,觀察產氣情況。
B3.2 結果報告
凡乳糖膽鹽發酵管產酸產氣,乳糖發酵管產酸產氣,在伊紅美藍平板上有典型大腸菌落,革蘭氏染色為陰性無芽胞桿菌,可報告被檢樣品檢出大腸桿菌。
B4 綠膿桿菌檢測方法
B4.1 操作步驟
取樣液5 mL,加入到50 mL SCDLP培養液中,充分混勻,置35℃±2℃培養18~24 h。如有綠膿桿菌生長,培養液表面呈現一層薄菌膜,培養液常呈黃綠色或藍綠色。從培養液的薄菌膜處挑取培養物,劃線接種十六烷三甲基溴化銨瓊脂平板,置35℃±2℃培養18~24 h,觀察菌落特征。綠膿桿菌在此培養基上生長良好,菌落扁平,邊緣不整,菌落周圍培養基略帶粉紅色,其他菌不長。
取可疑菌落涂片作革蘭氏染色,鏡檢為革蘭氏陰性菌者應進行下列試驗:
氧化酶試驗:取一小塊潔凈的白色濾紙片放在滅菌平皿內,用無菌玻棒挑取可疑菌落涂在濾紙片上,然后在其上滴加一滴新配制的1%二甲基對苯二胺試液,30 s內出現粉紅色或紫紅色,為氧化酶試驗陽性,不變色者為陰性。
綠膿菌素試驗:取2~3個可疑菌落,分別接種在綠膿菌素測定用培養基斜面,35℃±2℃培養24 h,加入三氯甲烷3~5 mL,充分振蕩使培養物中可能存在的綠膿菌素溶解,待三氯甲烷呈藍色時,用吸管移到另一試管中并加入1 mol/L的鹽酸1 mL,振蕩后靜置片刻。如上層出現粉紅色或紫紅色即為陽性,表示有綠膿菌素存在。
硝酸鹽還原產氣試驗:挑取被檢菌純培養物接種在硝酸鹽胨水培養基中,置35℃±2℃培養24 h,培養基小倒管中有氣者即為陽性。
明膠液化試驗:取可疑菌落純培養物,穿刺接種在明膠培養基內,置35℃±2℃培養24h,取出放于4~10℃,如仍呈液態為陽性,凝固者為陰性。
42℃生長試驗:挑取可疑培養物,接種在普通瓊脂斜面培養基上,置42℃培養24~48 h,有綠膿桿菌生長為陽性。
B4.2 結果報告
被檢樣品經增菌分離培養后,證實為革蘭氏陰性桿菌,氧化酶及綠膿桿菌試驗均為陽性者,即可報告被檢樣品中檢出綠膿桿菌。如綠膿菌素試驗陰性而液化明膠、硝酸鹽還原產氣和42℃生長試驗三者皆為陽性時,仍可報告被檢樣品中檢出綠膿桿菌。
B5 金黃色葡萄球菌檢測方法
B5.1 操作步驟
取樣液5 mL,加入到50 mL SCDLP培養液中,充分混勻,置35℃±2℃培養24 h。
自上述增菌液中取1~2接種環,劃線接種在血瓊脂培養基上,置35℃±2℃培養24~48 h。在血瓊脂平板上該菌菌落呈金黃色,大而突起,圓形,不透明,表面光滑,周圍有溶血圈。
挑取典型菌落,涂片作革蘭氏染色鏡檢,金黃色葡萄球菌為革蘭氏陽性球菌,排列成葡萄狀,無芽胞與莢膜。鏡檢符合上述情況,應進行下列試驗:
甘露醇發酵試驗:取上述菌落接種甘露醇培養液,置35℃±2℃培養24 h,發酵甘露醇產酸者為陽性。
血漿凝固酶試驗:玻片法:取清潔干燥載玻片,一端滴加一滴生理鹽水,另一端滴加一滴兔血漿,挑取菌落分別與生理鹽水和血漿混合,5 min如血漿內出現團塊或顆粒狀凝塊,而鹽水滴仍呈均勻混濁無凝固則為陽性,如兩者均無凝固則為陰性。凡鹽水滴與血漿滴均有凝固現象,再進行試管凝固酶試驗; 試管法:吸取1∶4新鮮血漿0.5 mL,放滅菌小試管中,加入等量待檢菌24 h肉湯培養物0.5 mL。混勻,放35℃±2℃溫箱或水浴中,每半小時觀察一次,24 h之內呈現凝塊即為陽性。同時以已知血漿凝固酶陽性和陰性菌株肉湯培養物各0.5 mL作陽性與陰性對照。
B5.2 結果報告
凡在瓊脂平板上有可疑菌落生長,鏡檢為革蘭氏陽性葡萄球菌,并能發酵甘露醇產酸,血漿凝固酶試驗陽性者,可報告被檢樣品檢出金黃色葡萄球菌。
B6 溶血性鏈球菌檢測方法
B6.1 操作步驟
取樣液5 mL加入到50 mL葡萄糖肉湯,35℃±2℃培養24 h。
將培養物劃線接種血瓊脂平板,35℃±2℃培養24 h觀察菌落特征。溶血性鏈球菌在血平板上為灰白色,半透明或不透明,針尖狀突起,表面光滑,邊緣整齊,周圍有無色透明溶血圈。
挑取典型菌落作涂片革蘭氏染色鏡檢,應為革蘭氏陽性,呈鏈狀排列的球菌。鏡檢符合上述情況,應進行下列試驗:
鏈激酶試驗:吸取草酸鉀血漿0.2 mL(0.01 g草酸鉀加5 mL兔血漿混勻,經離心沉淀,吸取上清液),加入0.8 mL滅菌生理鹽水,混勻后再加入待檢菌24 h肉湯培養物0.5 mL和0.25%氯化鈣0.25 mL,混勻,放35℃±2℃水浴中,2 min觀察一次(一般10 min內可凝固),待血漿凝固后繼續觀察并記錄溶化時間。如2 h內不溶化,繼續放置24 h觀察,如凝塊全部溶化為陽性,24 h仍不溶化為陰性。
桿菌肽敏感試驗:將被檢菌菌液涂于血平板上,用滅菌鑷子取每片含0.04單位桿菌肽的紙片放在平板表面上,同時以已知陽性菌株作對照,在35℃±2℃下放置18~24 h,有抑菌帶者為陽性。
B6.2 結果報告
鏡檢革蘭氏陽性鏈狀排列球菌,血平板上呈現溶血圈,鏈激酶和桿菌肽試驗陽性,可報告被檢樣品檢出溶血性鏈球菌。
B7 真菌菌落總數檢測方法
B7.1 操作步驟
待上述生理鹽水樣液自然沉降后取上清液作真菌計數,共接種5個平皿,每一個平皿中加入1mL樣液,然后用冷卻至45℃左右的熔化的沙氏瓊脂培養基15~25 mL倒入每個平皿內混合均勻,瓊脂凝固后翻轉平皿置25℃±2℃培養7天,分別于3、5、7天觀察,計算平板上菌落數,如果發現菌落蔓延,以前一次的菌落計數為準。
B7.2 結果報告
菌落呈片狀生產的平板不宜采用;計數符合要求的平板上的菌落,按式(B2)計算結果:
當菌落數在100以內,按實有數報告,大于100時采用二位有效數字。
如果樣品菌落總數超過本標準的規定,按B7.3進行復檢和結果報告。
B7.3 復檢方法
將留存的復檢樣品依前法復測2次,2次結果都達到本標準的規定,則判定被檢樣品合格,其中有任何1次結果超過本標準規定,則判定被檢樣品不合格。
B8 真菌定性檢測方法
B8.1 操作步驟
取樣液5mL加入到50mL沙氏培養基中,25℃±2℃培養7天,逐日觀察有無真菌生長。
B8.2 結果報告
培養管混濁應轉種沙氏瓊脂培養基,證實有真菌生長,可報告被檢樣品檢出真菌。
附 錄 C
(標準的附錄)
產品殺菌性能、抑菌性能與穩定性測試方法
C1 樣品采集
為使樣品具有良好的代表性,應于同一批號三個運輸包裝中至少隨機抽取20件小銷售包裝樣品,其中5件留樣,5件做抑菌或殺菌性能測試,10件做穩定性測試。
C2 試驗菌與菌液制備
C2.1 試驗菌
C2.1.1 細菌:金黃色葡萄球菌 (ATCC 6538),大腸桿菌 (8099或ATCC 25922)。
C2.1.2 酵母菌:白色念珠菌(ATCC 10231)。
菌液制備:取菌株第3~14代的營養瓊脂培養基斜面新鮮培養物(18~24h),用5mL0.03mol/L磷酸鹽緩沖液(以下簡稱PBS)洗下菌苔,使菌懸浮均勻后用上述PBS稀釋至所需濃度。
C3 殺菌性能試驗方法
該試驗取樣部位,根據被試產品生產者的說明而確定。
C3.1 中和劑鑒定試驗
進行殺菌性能測試必須通過以下中和劑鑒定試驗。
C3.1.1試驗分組
1)染菌樣片+5mLPBS
2)染菌樣片+5mL中和劑
3)染菌對照片+5mL中和劑
4)樣片+5mL中和劑+染菌對照片
5)染菌對照片+5mLPBS
6)同批次PBS
7)同批次中和劑
8)同批次培養基。
C3.1.2 評價規定
1)第1組無試驗菌,或僅有極少數試驗菌菌落生長。
2)第2組有較第1組為多,但較第3、4、5組為少的試驗菌生長,并符合要求。
3)第3、4、5組有相似量試驗菌生長,并在1×104~9×104cfu/片之間,其組間菌落數誤差率不超過15%。
4)第6~8組無菌生長。
5)連續3次試驗取得合格評價。
C3.2 殺菌試驗
C3.2.1 操作步驟
將試驗菌24h斜面培養物用PBS洗下,制成菌懸液(要求的濃度為:用100μL滴于對照樣片上,回收菌數為1×104~9×104cfu/片)。
取被試樣片(2.0cm×3.0cm)和對照樣片(與試樣同質材料,同等大小,但不含抗菌材料,且經滅菌處理)各4片,分成4組置于4個滅菌平皿內。
取上述菌懸液,分別在每個被試樣片和對照樣片上滴加100μL,均勻涂布,開始計時,作用2、5、10、20min,用無菌鑷分別將樣片投入含5mL相應中和劑的試管內,充分混勻,作適當稀釋,然后取其中2~3個稀釋度,分別吸取0.5mL置于兩個平皿,用涼至40~45℃的營養瓊脂培養基(細菌)或沙氏瓊脂培養基(酵母菌)15mL作傾注,轉動平皿,使其充分均勻,瓊脂凝固后翻轉平板,35℃±2℃培養48h(細菌)或72h(酵母菌),作活菌菌落計數。
試驗重復3次,按式(C1)計算殺菌率:
X3=(A-B)/A×100%...(C1)
C3.2.2 評價標準
殺菌率≥90%,產品有殺菌作用。
C4 溶出性抗(抑)菌產品抑菌性能試驗方法
C4.1 操作步驟
將試驗菌24h斜面培養物用PBS洗下,制成菌懸液(要求的濃度為:用100μL滴于對照樣片上或5mL樣液內,回收菌數為1×104~9×104cfu/片或mL)。
取被試樣片(2.0cm×3.0cm)或樣液(5mL)和對照樣片或樣液(與試樣同質材料,同等大小,但不含抗菌材料,且經滅菌處理)各4片(置于滅菌平皿內)或4管。
取上述菌懸液,分別在每個被試樣片或樣液和對照樣片或樣液上或內滴加100μL,均勻涂布/混合,開始計時,作用2、5、10、20min,用無菌鑷分別將樣片或樣液(0.5mL)投入含5mLPBS的試管內,充分混勻,作適當稀釋,然后取其中2~3個稀釋度,分別吸取0.5mL,置于兩個平皿,用涼至40~45℃的營養瓊脂培養基(細菌)或沙氏瓊脂培養基(酵母菌)15mL作傾注,轉動平皿,使其充分均勻,瓊脂凝固后翻轉平板,35℃±2℃培養48h(細菌)或72h(酵母菌),作活菌菌落計數。
試驗重復3次,按式(C2)計算抑菌率:
X4=(A-B)/A×100%...(C1)
C4.2 評價標準
抑菌率≥50%~90%,產品有抑菌作用,抑菌率≥90%,產品有較強抑菌作用。
C5 非溶出性抗(抑)菌產品抑菌性能試驗方法
C5.1 操作步驟
稱取被試樣片(剪成1.0cm×1.0cm大小)0.75g分裝包好。
將0.75g重樣片放入一個250mL的三角燒瓶中,分別加入70mLPBS和5mL菌懸液,使菌懸液在PBS中的濃度為1×104~9×104cfu/mL。
將三角燒瓶固定于振蕩搖床上,以300r/min振搖1h。
取0.5mL振搖后的樣液,或用PBS做適當稀釋后的樣液,以瓊脂傾注法接種平皿,進行菌落計數。
同時設對照樣片組和不加樣片組,對照樣片組的對照樣片與被試樣片同樣大小,但不含抗菌成分,其他操作程序均與被試樣片組相同,不加樣片組分別取5mL菌懸液和70mLPBS加入一個250mL三角燒瓶中,混勻,分別于0時間和振蕩1h后,各取0.5mL菌懸液與PBS的混合液做適當稀釋,然后進行菌落計數。
試驗重復3次,按式(C3)計算抑菌率:
X5=(A-B)/A×100%...(C1)
C5.2 評價標準
不加樣片組的菌落數在1×104~9×104cfu/mL之間,且樣品振蕩前后平均菌落數差值在10%以內,試驗有效;被試樣片組抑菌率與對照樣片組抑菌率的差值>26%,產品具有抗菌作用。
C6 穩定性測試方法
C6.1 測試條件
C6.1.1 自然留樣:將原包裝樣品置室溫下至少1年,每半年進行抑菌或殺菌性能測試。
C6.1.2 加速試驗:將原包裝樣品置54~57℃恒溫箱內14天或37~40℃恒溫箱內3個月,保持相對濕度>75%,進行抑菌或殺菌性能測試。
C6.2 評價標準
產品經自然留樣,其殺菌率或抑菌率達到附錄C3或附錄C4、附錄C5中規定的標準值,產品的殺菌或抑菌作用在室溫下的保持時間即為自然留樣時間。
產品經54℃加速試驗,其殺菌率或抑菌率達到附錄C3或附錄C4、附錄C5中規定的標準值,產品的殺菌或抑菌作用在室溫下至少保持一年。
產品經37℃加速試驗,其殺菌率或抑菌率達到附錄C3或附錄C4、附錄C5中規定的標準值,產品的殺菌或抑菌作用在室溫下至少保持二年。
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||